O que você precisa estudar hoje?
A palavra átomo surgiu na Grécia Antiga, significando “não divisível”, para designar a menor parte da matéria. Acreditava-se que, ao dividir um corpo centenas de vezes, chegaria-se a uma pequena partícula que seria indivisível, a menor parte da matéria, sendo ela formadora de todas as coisas.
Acerca dessa partícula, o primeiro modelo para caracterizá-la foi elaborado por John Dalton, porém, anos mais tarde, descobriu-se que a partícula atômica seria mais complexa do que a proposta por esse cientista e, a partir daí, muitas teorias foram desenvolvidas até chegar nos modelos subatômicos que conhecemos hoje, caracterizados por partículas ainda menores que o átomo, sendo elas os elétrons, os prótons e os nêutrons.
Modelo de Dalton
Em sua teoria atômica, de 1808, Dalton afirmava que:
- Átomos de elementos diferentes possuem propriedades diferentes entre si;
- Átomos de um mesmo elemento possuem propriedades iguais e de peso invariável;
- Átomos são a menor porção da matéria, caracterizados como esferas maciças e indivisíveis;
- Átomos permanecem inalterados em reações químicas;
- Átomos não podem ser criados e nem destruídos;
- A massa total de um corpo é igual à soma das massas dos átomos dos elementos que o constituem.
O conceito de átomo de Dalton é considerado, hoje, primitivo, porém significativo para o desenvolvimento da química em sua época. Seu modelo de átomo em forma de esfera, também conhecido como modelo bola de bilhar, ainda é utilizado para fins didáticos.
Modelo de Thomson
O cientista inglês William Crookes, em 1850, realizou um experimento utilizando uma ampola, a qual submeteu a um gás a uma pressão menor que a pressão atmosférica e a uma alta tensão, por meio de eletrodos metálicos conectados à ampola, um positivo (cátodo) e outro negativo (ânodo). Com isso, observou feixes de partículas com carga negativa, que saiam do cátodo, que colidiam com as moléculas do gás e, assim, ocorria a ionização do gás e liberação de luz, iluminando a ampola. Por meio desse experimento, Crookes concluiu sobre a existência dos raios catódicos, modo como ficaram conhecidos os “raios” que saíam do cátodo.
Posteriormente, em 1886, Goldstein realizando experimentos com a ampola de Crookes, porém com algumas modificações, observou que, além dos raios catódicos emitidos (que eram negativos), havia também novos “raios” sendo emitidos na direção oposta, de forma que concluiu serem de carga positiva. Além disso, visualizou que a combinação dos raios em direções opostas gerava uma “neutralidade” elétrica da matéria. Esses raios foram nomeados de “raios canais” e, com isso, conseguiu afirmar que a matéria possui natureza elétrica.
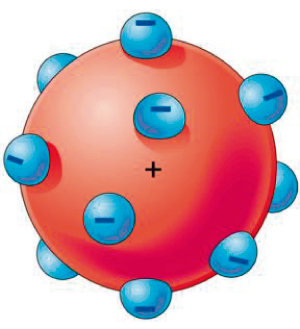
Por meio dessas afirmações, Thomson, em 1897, a partir da determinação da relação carga-massa dos raios catódicos, conseguiu comprovar experimentalmente que os “raios” eram feixes de partículas dotadas de cargas. Esta é considerada, oficialmente, a descoberta da partícula subatômica negativa, o elétron, nome atribuído do grego “elektron”, que significa âmbar (resina vegetal), devido à capacidade do âmbar em atrair objetos leves, a partir de sua fricção. E, em 1898, o modelo atômico de Thomson foi desenvolvido. Segundo ele, o átomo é uma massa positiva coberta por elétrons negativos, contrariando, então, a teoria de Dalton, uma vez que Thomson afirma que o átomo é uma partícula divisível e que possui natureza elétrica. Seu modelo também é conhecido como modelo pudim de passas.
Modelo de Rutherford
Rutherford, em 1911, apresentou a teoria para seu modelo atômico, afirmando que o modelo apresentado até então, de Thomson, estava incorreto. Para isso, realizou um experimento que consistia em colocar, no interior de um bloco de chumbo, um fragmento radioativo de polônio. A radiação emitida pelo polônio seguia em direção a uma fina lâmina de ouro que estava cercada por um anteparo fluorescente - uma placa de metal coberta de sulfeto de zinco. O pedaço de polônio desprendia uma radiação de partículas alfa, que seguiam em direção à lâmina de ouro. A placa de sulfeto de zinco, ao receber essa radiação, gerou uma luminosidade nos locais onde as partículas alfa incidiram. Com isso, Rutherford percebeu que:
- Muitas das partículas atravessavam a folha de ouro;
- Um número pequeno de partículas alfa eram refletidas e não atravessam a lâmina e;
- Poucas partículas mudaram a trajetória quando atravessaram a lâmina.
A partir dessas observações, contrariando Thomson, concluiu que o átomo não era apenas uma massa de carga elétrica positiva coberta por elétrons. O átomo, na verdade, possuiria um núcleo de carga elétrica positiva de tamanho muito pequeno, em relação ao seu tamanho total, e este núcleo conteria praticamente toda a massa do átomo e estaria rodeado por elétrons de carga elétrica negativa, os quais descreveriam órbitas helicoidais em altas velocidades. Rutherford comparava o Sol ao núcleo do átomo e os elétrons aos planetas do Sistema Solar, por isso seu modelo foi chamado de “modelo planetário”.
Prótons, nêutrons e elétrons
O átomo pode ser descrito como possuindo uma eletrosfera composta por elétrons, de carga negativa e massa desprezível. Seu núcleo é composto por prótons, partículas carregadas positivamente e nêutrons partículas de carga neutra. Os nêutrons possuem a função de minimizar os efeitos das forças de repulsão entre os prótons, no núcleo, tornando-o mais estável e os prótons neutralizam a carga dos elétrons, tornando o átomo eletricamente neutro. Cada partícula apresenta características distintas em relação a sua massa e carga: prótons possuem carga elétrica positiva (+1) e uma massa unitária (1). Nêutrons não possuem carga elétrica (0) e possuem massa aproximadamente unitária (≅ 1). Elétrons, possuem carga elétrica negativa (-1) e sua massa deve ser considerada desprezível (por ser 1.836 vezes menor que a massa de um próton/ nêutron).
Além disso, a razão entre o raio do átomo e o raio de seu núcleo varia entre 10.000 e 100.000. Para ilustrar essa característica do átomo, imagine que o átomo fosse do tamanho de um estádio de futebol, tal que o núcleo seria a cabeça de um alfinete no centro do campo e a eletrosfera estaria localizada na arquibancada, distante, circundando esse ponto.
Número atômico (Z)
Designa-se número atômico como o número de prótons presentes no núcleo de um átomo. É o que caracteriza cada elemento químico, ou seja, não existem átomos de elementos químicos diferentes com o mesmo número atômico. O número atômico foi descoberto pelo físico britânico Henry Moseley, o qual conseguiu determinar a carga do núcleo atômico e, sabendo a carga, é possível determinar a quantidade de prótons em qualquer átomo.
Número de massa (A)
Número de massa é definido como sendo a soma de prótons e nêutrons presentes no núcleo de um átomo (A = P + N).
Íons
Um átomo pode adquirir diferentes cargas, uma vez que o número de elétrons em sua eletrosfera é variável. Um átomo pode “ganhar” ou “perder” elétrons, dependendo da forma como liberam ou recebem energia. Quando carregados eletricamente, ou seja, quando o número de prótons difere do número de elétrons, os átomos são chamados de íons. Quando positivos, ou seja, possuem mais prótons do que elétrons, os íons são chamados cátions e quando negativos, ou seja, possuem mais elétrons do que prótons, são chamados de ânions. Quando um átomo possui o número de elétrons igual ao número de prótons, dizemos que este átomo é eletricamente neutro. É importante ter em mente que o que é alterado é o número de elétrons, não o de prótons: a princípio, o átomo pode ganhar ou perder elétrons, somente.
Representação dos elementos químicos
Os elementos químicos foram organizados por Berzelius, que os representou por símbolos escolhidos a partir das primeiras letras do nome do elemento em latim ou de outras fontes como grego, alemão e homenagens a locais ou pessoas. A primeira letra é presentada em maiúscula e a segunda em minúscula.
Átomos isótopos
Átomos são chamados de isótopos quando possuem o mesmo número atômico, mas apresentam números de nêutrons e de massa diferentes.
Exemplo:
Carbono e o carbono-14 possuem Z = 6, mas o carbono possui A = 12 e o carbono-14 possui A = 14, ou seja, o carbono-14 possui dois nêutrons a mais que o carbono.
Átomos isóbaros
Átomos isóbaros pertencem a elementos distintos, porém possuem o mesmo número de massa. Apesar disso, apresentam número atômico e de nêutrons diferentes.
Exemplo:
Cálcio e potássio possuem o número de massa (A = 40), mas o cálcio possui número atômico Z = 20 e número de nêutrons igual a 20, enquanto o potássio tem Z =19 e o número de nêutrons igual a 21.
Átomos isótonos
Átomos isótonos são átomos que diferem no número atômico (número de prótons) e no número de massa, porém apresentam o mesmo número de nêutrons.
Exemplo:
O boro e o carbono apresentam cada um 6 nêutrons, mas o boro possui Z = 5 e A = 11, enquanto o carbono possui Z = 6 e A = 12.
Átomos isoeletrônicos
Átomos isoeletrônicos podem ser átomos neutros, cátions ou íons de diferentes elementos químicos que possuem mesmo número de elétrons.
Exemplo:
O cátion de magnésio (Mg2+) e o ânion de flúor (F-) possuem o número de elétrons igual a 10.
Modelo de Bohr
O modelo de Rutherford explicou como as partículas subatômicas distribuíam-se no átomo, de forma que, segundo esse modelo, os elétrons são partículas negativas que giram ao redor do núcleo. Porém, se isso de fato ocorresse, essa partícula elétrica em movimento deveria emitir ondas eletromagnéticas, segundo a mecânica clássica, e isso faria com que o elétron perdesse energia gradativamente até se chocar com o núcleo, tornando o átomo instável.
Bohr, por meio de experimentos, constatou que um gás emitia luz quando uma corrente elétrica passava por ele. Isso se explica pelo fato de que os elétrons, em seus átomos, absorvem energia elétrica e depois a liberam na forma de luz, mas isso acontece apenas em faixas de energia bem específicas, ou seja, o átomo recebe ou libera energia (liberando-a em forma de luz) em quantidades características. Com isso, ele deduziu que as órbitas de um átomo têm um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em uma órbita é quantizada. Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia. Assim, se um átomo absorve energia de uma descarga elétrica, alguns de seus elétrons ganham energia o bastante e passam para um nível de energia maior, de forma que, nesse caso, o átomo está em estado excitado. Quando ele retorna para sua órbita de origem, ele libera a mesma quantidade de energia, na forma de luz. Essa característica pode ser observada no espectro de emissão do carbono, abaixo. Observe que a emissão de luz (linhas mais claras) acontece apenas em regiões específicas.
A partir daí, Bohr aperfeiçoou o modelo atômico de Rutherford e, por meio das descrições quânticas da radiação eletromagnética, propostas por Albert Einstein e Max Planck, desenvolveu seu modelo atômico a partir de quatro postulados:
1 - Os elétrons que circundam o núcleo atômico existem em órbitas que possuem níveis de energia quantizados;
2 - A energia total do elétron não pode apresentar um valor qualquer, mas valores múltiplos de um quantum (fóton).
3 - Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida (ou suprida) por um simples fóton, que tem energia exatamente igual à diferença de energia entre as órbitas em questão;
4 - As órbitas permitidas dependem de valores quantizados (bem definidos) de momento angular orbital L. Admite-se a existência de 7 camadas eletrônicas, designadas pelas letras maiúsculas: K, L, M, N, O, P e Q, ou por um número natural associado a ela (n = 1, 2, ..., 7).
Orbitais
Com base em experimentos desenvolvidos por diversos cientistas durante o Século XIX, verificou-se que a luz apresenta um comportamento dual, ou seja, como partícula e como onda. Em 1924, o físico francês Louis De Broglie lançou a hipótese de que, se a luz apresenta natureza dual, uma partícula também apresentaria características ondulatórias. Então, procurou associar a natureza dual da luz com o comportamento do elétron e concluiu que todo elétron em movimento está associado a uma onda característica, sendo isso considerado um dos princípios básicos do modelo atômico atual.
No final da década de 1920, Heisenberg formulou o chamado Princípio da Incerteza. De acordo com esse princípio, não podemos determinar com precisão e simultaneamente a posição e o momento de um elétron, porque, para isso, deve-se emitir sobre ele uma onda de curto comprimento, porém tais ondas possuem alta energia, que terminam por alterar a velocidade do elétron, uma vez que ele também se comporta como onda, ou seja, o experimento alteraria a característica que se deseja determinar.
Mas, apesar de ser impossível determinar a posição exata de um elétron, pode-se dizer que existente uma grande probabilidade de se encontrar um elétron em uma região imaginária especifica, nomeada como orbital, de formato esférico, em geral. O elétron pode não estar exatamente em um orbital, porém a probabilidade de que esteja nele é máxima.
Subníveis de energia
Já vimos que os elétrons se encontram dispostos em camadas, tal que cada camada possui um nível de energia associada a ela. É importante destacar que cada camada também pode comportar um número máximo de elétrons:
Ainda, cada nível de energia, pode ser dividido em até quatro subníveis de energia; s, p, d, f, assim dispostos em ordem crescente de energia, ou seja, o subnível “s” é o que possui menor energia, enquanto o subnível “f” é o mais energético.
Perceba que cada camada por ter até quatro subníveis de energia: a camada K (n=1) possui apenas um subnível, o “s”; L (n=2) possui dois subníveis, “s”’ e “p”, e assim por diante.
Isso também é consequência da quantidade de orbitais que os subníveis, por sua vez, possuem, sendo que cada orbital comporta até dois elétrons, de forma que o subnível “s” possui apenas 1 orbital (até 2 elétrons); o subnível “p” possui 3 orbitais (até 6 elétrons); o subnível “d” possui 5 orbitais (até 10 elétrons) e, por fim, o subnível “f” possui 7 orbitais (até 14 elétrons).
Assim, podemos escrever 1s² para designar os dois elétrons do subnível “s”, da camada K (1), ou 2s²2p6, os elétrons dos subníveis “s” e “p” da camada L (2), por exemplo, como veremos com mais detalhes nos tópicos de distribuição eletrônica e números quânticos.
Distribuição eletrônica
Wolfgang Pauli elaborou, em 1925, o Princípio da Exclusão, segundo o qual partículas subatômicas não podem ocupar o mesmo estado quântico simultaneamente, devido à existência de uma força de repulsão entre os elétrons: uma vez que elétrons giram em torno de seu próprio eixo, eles geram um campo magnético e, então, somente seria possível dois elétrons ocuparem o mesmo orbital caso possuíssem orientações opostas, pois, assim, a atração magnética gerada compensaria a força de repulsão elétrica. Essas possíveis orientações, que partículas subatômicas podem apresentar quando imersas em um campo magnético, passou a ser conhecida como spin.
O princípio de Aufbau, ou princípio da estruturação, é utilizado para determinar a configuração eletrônica de um átomo ou íon. Postula um processo hipotético em que um átomo é desenvolvido pela adição progressiva de elétrons, que preenchem os orbitais atômicos disponíveis dos níveis de energia mais baixos até ocuparem níveis mais altos. Desse modo, deve-se adicionar elétrons um a um, até alcançar o número de elétrons desejado. Por exemplo, um elemento como o fósforo que possui 15 elétrons, possuirá a seguinte distribuição eletrônica: 1s2 2s2 2p6 3s2 3p3.
Assim, Linus Pauling desenvolveu um diagrama para facilitar o processo de distribuição eletrônica, sem que fosse necessário decorar a sequência de energia crescente dos subníveis, apenas seguindo as sequências diagonais do diagrama. Apesar de ser possível determinar previamente a configuração eletrônica da maioria dos átomos, existem algumas exceções: alguns elementos apresentam variações no nível mais energético da distribuição eletrônica, como, por exemplo, seguindo a regra de distribuição, a da prata seria: 47Ag – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9. Porém a configuração correta é: 47Ag – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5s1.
Distribuição eletrônica nos orbitais
Seguindo a regra de Hund para distribuições eletrônicas nos subníveis dos orbitais, durante o preenchimento das orbitais de um mesmo nível energético, cada orbital deve receber um elétron com o mesmo spin e, posteriormente, cada um deve receber o segundo elétron com spin antiparalelo (oposto). Como qualquer partícula que possui carga em movimento gera um campo magnético, se houver orbitais com apenas um elétron, desemparelhado, ocorrerá um efeito paramagnético, em que ele será fracamente atraído por um campo magnético. Ainda, quando todos os elétrons estão emparelhados, há uma fraca repulsão a campos magnéticos, chamada diamagnetismo.
Números quânticos
Número quântico é um conjunto de quatro números que estão associados às quatro principais características que descrevem cada elétron de um átomo. Essas características são: nível de energia; subnível de energia; orbital que ocupa; direção do spin. O nível de energia está associado ao número quântico principal (n), a camada, nível de energia, em que o elétron se encontra. Já o número quântico secundário (ℓ) está associado ao subnível de energia; o número quântico magnético (m) representa cada um dos orbitais de um subnível e; o número quântico de spin (s) representa a direção de cada elétron em um dos orbitais de um subnível, valendo ±1/2. Por meio dos quatro número quânticos poderá ser determinado cada elétron de um átomo. Sendo que o mesmo conjunto de números quânticos nunca poderá ser apresentado por dois elétrons diferentes em um mesmo átomo.
Exemplo:
Determine os quatro números quânticos do último elétron do flúor (9F):
Distribuição eletrônica: 1s22s22p5
O último elétron está indicado em vermelho. Assim, seus números quânticos são: n = 2; l = 1; m = 0; s = +1/2.
- ânions
- átomo
- átomos
- camadas eletrônicas
- cátions
- comportamento dual
- configuração eletrônica
- diamagnetismo
- distribuição eletrônica
- distribuição eletrônica nos orbitais
- elementos químicos
- elétrons
- eletrosfera
- fóton
- Heisenberg
- íons
- isóbaros
- isoeletrônicos
- isótonos
- isótopos
- modelo atômico
- modelo bola de bilhar
- modelo de bohr
- modelo de Dalton
- modelo de rutherford
- modelo de thomson
- modelo planetário
- modelo pudim de passas
- modelos subatômicos
- nêutrons
- níveis de energia
- número atômico
- número de massa
- número quântico de spin
- número quântico magnético
- número quântico principal
- número quântico secundário
- números quânticos
- orbitais
- paramagnético
- partículas alfa
- princípio da estruturação
- princípio da exclusão
- princípio da incerteza
- prótons
- quantum
- química
- raios canais
- raios catódicos
- regra de Hund
- spin
- subníveis de energia
- tabela periódica e ligações
- teoria atômica

Deixe um comentário