Em 1884 o químico sueco Svante August Arrhenius (1859 - 1927) propôs a classificação de alguns compostos químicos como bases e ácidos, baseado nos íons (átomo carregado eletricamente que perdeu ou ganhou elétrons) que se formam a partir deles quando adicionamos água.
⠀
Em resumo, a teoria dos ácidos e bases de Arrhenius nos diz que, quando adicionado água, o ácido ioniza liberando unicamente o hidrogênio como cátion (íon com carga positiva), já a base dissocia liberando hidroxila como ânion (íon com carga negativa).
⠀
Arrhenius chegou a esta conclusão após realizar uma serie de experimentos testando a condutividade elétrica, que pode ser interpretado como a facilidade que um material tem em conduzir corrente elétrica.
⠀
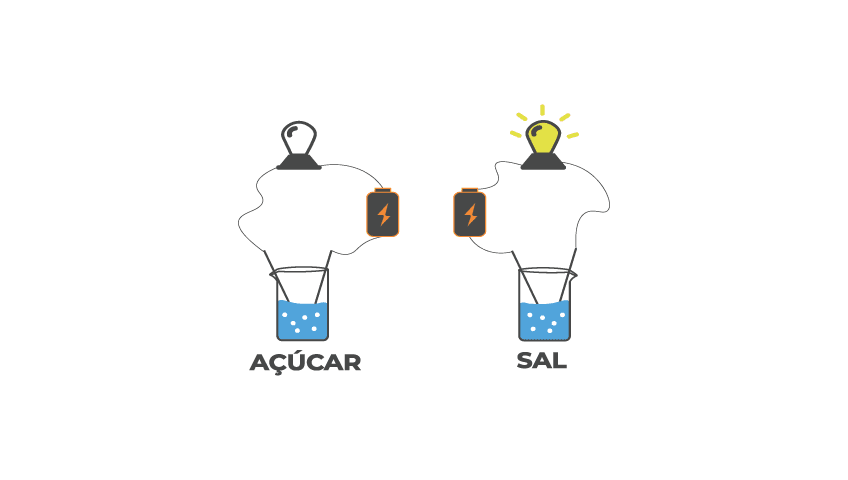
O experimento de Arrhenius baseavam-se em dissolver sais e açucares na água e em seguida verificar se solução formada era capaz de conduzir eletricidade. Arrhenius observou que o açúcar dissolvido na água não conduzia eletricidade, já o sal era capaz de conduzir eletricidade.
⠀
O sal dissolvido na água gerava íons, o que permitia a passagem de corrente elétrica, estes compostos são chamados de eletrólitos. O açúcar dissolvido na água gerava moléculas neutras que não eram capazes de conduzir corrente elétrica, estes compostos são chamados de não eletrólito.
⠀
Você gostou dessa dica de química? Deixe aqui seu comentário. 👇👇




Deixe um comentário