Desde a antiguidade os pensadores discutiam de que era feita a matéria. Eles desenvolveram a teoria do átomo, que significa “indivisível”. Os modelos atômicos são representações da forma e comportamento dos átomos. Ao longo do tempo alguns modelos foram desenvolvidos:
Modelo de Dalton - desenvolvida em 1808, por John Dalton. Também chamado de modelo da bola de bilhar, tem como características:
- Toda e qualquer matéria é composta por pequenas partículas chamadas átomos;
- Átomos de diferentes elementos possuem diferentes propriedades, mas os átomos do mesmo elemento são idênticos;
- O átomo possui uma forma esférica e é maciço e indivisível.
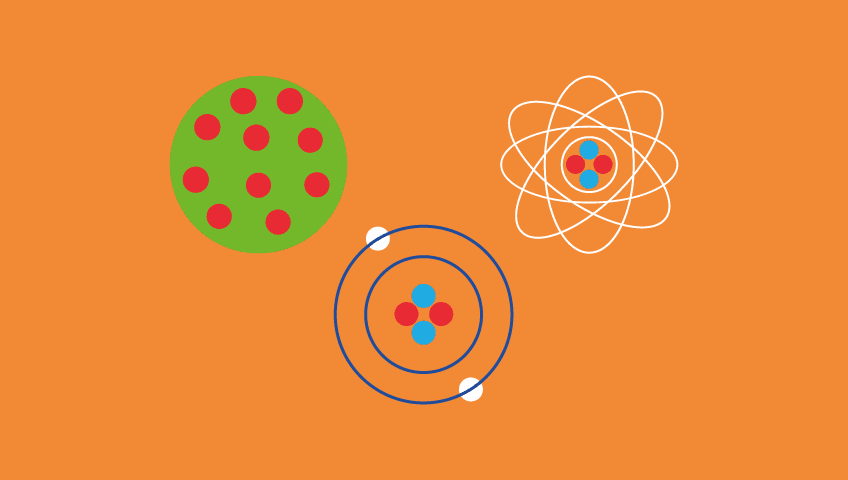
Modelo de Thomson - Em 1887, Thomson sugeriu que os elétrons eram um constituinte universal da matéria. Ele apresentou as primeiras ideias relativas à estrutura interna dos átomos. Seu modelo ficou conhecido como pudim de ameixa. As principais característica de seu modelo são:
- O átomo é uma esfera, mas não maciça;
- O átomo é neutro;
- Como o átomo apresenta elétrons, que possuem cargas negativas, logo, deve apresentar partículas positivas para que a carga final seja nula.
Modelo de Rutherford - conhecido como modelo planetário, se assemelha ao sistema solar em miniatura, no qual os elétrons se movem em órbitas circulares, ao redor do núcleo.
- O átomo é composto por um pequeno núcleo carregado com cargas positivas e é rodeado por uma grande eletrosfera, uma região envolta do núcleo que contém elétrons;
- No núcleo está concentrada a carga positiva e a maior parte da massa do átomo.
Modelo de Rutherford – Bohr - Este modelo introduziu os seguintes conceitos:
- Os elétrons descrevem órbitas determinadas;
- O átomo é pequeno, mas sua maior parte é espaço vazio;
- Quando os elétrons saltam de uma órbita para a outra ele emite luz.
Você gostou dessa dica de química? Deixe aqui seu comentário. 👇




Deixe um comentário