O que você precisa estudar hoje?
Você já percebeu o sabor azedo de um limão, ou o adstringente, de “amarrar a boca”, de uma banana verde? Esses sabores são característicos de duas funções inorgânicas muito importantes da química, os ácidos e bases, respectivamente. Mas, se precisássemos determinar com que tipo de substância química estamos lidando, o paladar seria uma forma muito perigosa de fazer isso. Desta forma, Arrhenius, químico sueco nascido em 1859, desenvolveu uma teoria que nos permite determinar substâncias ácidas e básicas: segundo Arrhenius, através de diversos dados experimentais, a relação fundamental para ácidos e bases se dá pela ionização dessas substâncias quando misturadas com água.
Ácidos
Por Arrhenius, ácidos são compostos covalentes que se ionizam ao entrarem em contato com água, liberando o cátion , para que íon hidrônio (H3O+) seja formado.
Exemplo:
Assim, o composto HBr é um ácido de Arrhenius, pois forma o íon .
Classificação dos ácidos
Os ácidos podem ser classificados de diversas maneiras. Podemos classificá-los quanto à presença de oxigênio no composto, quanto à volatilidade, quanto ao número de hidrogênio ionizáveis e quanto à força do ácido.
Quanto à presença de oxigênio
Quando a composição de um ácido é isenta de oxigênio, chamamos esse ácido de hidrácido. Contudo, se o oxigênio estiver presente, o ácido será denominado oxiácido.
Exemplos:
HCl: O ácido clorídrico é um exemplo de hidrácido;
H2SO4: O ácido sulfúrico é um exemplo de oxiácido.
Quanto à volatilidade
A volatilidade é a capacidade de evaporação de uma substância. Assim, substâncias voláteis possuem uma maior pressão de vapor e uma menor temperatura de ebulição.
Os ácidos que possuem baixa temperatura de ebulição são considerados voláteis.
Exemplo:
HF: O ácido fluorídrico é um ácido gasoso na CNTP (Condições Normais de Temperatura e Pressão) que é considerado volátil.
Em contrapartida, os ácidos fixos são aqueles que possuem uma alta temperatura de ebulição.
Exemplo:
H2SO4: O ácido sulfúrico é um ácido líquido na CNTP que é considerado fixo.
Quanto ao número de hidrogênios
a) Monoprótico: São os ácidos que liberam somente um íon de hidrogênio;
b) Diprótico: São os ácidos que liberam somente dois íons de hidrogênio;
c) Triprótico: São os ácidos que liberam três íons de hidrogênio;
d) Tetraprótico: São os ácidos que liberam quatro íons de hidrogênio;
Quanto à força
A força de um ácido está diretamente relacionada a sua capacidade de ionização, não devendo-se confundir força com periculosidade. Um ácido forte não é necessariamente um ácido corrosivo, assim como um ácido fraco pode ser um ácido tóxico.
Em condições padrão, um ácido nunca se ioniza 100%, mas quanto mais próximo desse valor, mais forte o ácido será. A ionização pode ser dada pelo quociente da quantidade de moléculas ionizadas pela quantidade total de moléculas dissolvidas em água. Essa proporção é denominada grau de ionização, representada pelo símbolo ““. Assim:
Cada ácido irá possuir um valor fixo e este será útil para caracterizar o ácido.
Exemplos:
Grau de ionização do HCl: 92%
Grau de ionização do HF: 9%
Perceba que o grau de ionização do HCl está bem próximo de 100% e, portanto, ele é um ácido forte, enquanto o HF é um ácido fraco.
Existem ainda outras maneiras de classificar um ácido quanto à força (forte, moderado e fraco) sem que se saiba as quantidades de moléculas ionizadas da proporção.
a) Se for um hidrácido:
Para o caso em que o ácido for hidrácido, os ácidos serão dispostos da seguinte forma:
Fortes: HCl, Hbr e HI;
Moderado: HF;
Fracos: O restante dos hidrácidos.
b) Se for um oxiácido:
Dado um oxiácido genérico HxEOy (Lê-se “x átomos de H, Elemento característico E e y átomos de O), devemos subtrair a quantidade de átomos de oxigênio (y) da quantidade de átomos de oxigênio (x). Assim:
Fortes: Quando y-x>1;
Moderados: Quando y-x=1;
Fracos: Quando y-x<1.
Nomenclatura dos ácidos
A nomenclatura dos ácidos é de suma importância para a sua “tradução”, uma vez que através da leitura do nome de um ácido é possível descrever a fórmula molecular dele.
Nomenclatura dos hidrácidos
Quando o ácido é classificado como hidrácido, a sua nomenclatura é dada por “ácido” acrescido do nome do elemento com terminação “ídrico”.
Exemplos:
HCl: Ácido clorídrico;
HI: Ácido iodídrico;
HBr: Ácido bromídrico.
Nomenclatura dos oxiácidos
A nomenclatura dos oxiácidos depende do número de oxidação (NOX) do elemento característico do ácido (aquele que não é hidrogênio nem oxigênio).
Se o elemento característico tiver NOX baixo (+1/+2) a nomenclatura será dada da seguinte maneira:
“Ácido” + “hipo” + “nome do elemento” + “oso”.
Se o elemento possuir NOX (+3/+4):
“Ácido” + “nome do elemento” + “oso”.
Se o elemento possuir NOX elevado (+5/+6):
“Ácido” + “nome do elemento” + “ico”.
Se o elemento possuir NOX extremamente elevado(+7):
“Ácido” + “per” + “nome do elemento” + “ico”.
Exemplos:
H2SO4: Pelo estudo do NOX do enxofre (S) (+6), seu nome será “ácido sulfúrico”
HMnO4: Pelo estudo do NOX do manganês (Mn) (+7), seu nome será “ácido permangânico”.

Bases
Por Arrhenius, bases são compostos que sofrem dissociação iônica em água liberando o ânion hidroxila (OH–).
Exemplo:
Assim, o composto HBr é um ácido de Arrhenius, pois forma o íon H30+.
Classificação das bases
As bases podem ser classificadas por sua quantidade de hidroxilas, pela sua solubilidade em água e quanto sua força.
Quanto à quantidade de hidroxilas
As bases, quanto a quantidade de hidroxilas, são classificadas da seguinte forma:
a) Monobase: Que possuem apenas uma hidroxila presente;
b) Dibase: Que possuem apenas duas hidroxilas presentes;
c) Tribase: Que possuem três hidroxilas;
d) Tetrabase: Que possuem quatro hidroxilas.
Quanto à solubilidade
As bases podem ser classificadas da seguinte maneira:
a) Solúveis → São as bases formadas pelos elementos da família dos metais alcalinos (1A) e a base NH4OH;
b) Parcialmente solúveis → São as bases formadas pelos elementos da família dos metais alcalinos terrosos (2A), excluindo a base Mg(OH)2 que pode ser considerada insolúvel;
c) Praticamente insolúvel → São as demais bases.
Quanto à força
A força das bases é dada pela capacidade de dissolução delas. Essa dissolução pode ser dada pela seguinte razão:
Assim, as bases podem ser classificadas como:
Fortes: Quando é aproximadamente 100%. São as bases da família 1A e 2A, excluindo a base Mg(OH)2 que é classificada como uma base fraca.
Fracas: Quando é aproximadamente 0%. São todas as demais bases.
Nomenclatura das bases
As bases são nomeadas de maneira que o nome dessas bases sejam suficientes para a determinação da de suas fórmulas moleculares.
Bases de elementos com nox fixo
Quando o elemento característico possui somente um valor de nox, a regra de nomenclatura é dada da seguinte maneira:
“Hidróxido de” + “nome do elemento”.
Exemplos:
Na(OH): Hidróxido de sódio;
Sr(OH)2: Hidróxido de estrôncio.
Bases de elementos com nox variado
Quando o elemento característico possui mais de um nox, a nomenclatura pode ser dada da seguinte maneira:
a) Se for o maior nox do elemento:
“Hidroxido” + “nome do elemento” +”ico”;
b) Se for o menor nox do elemento:
“Hidróxido” + “Nome do elemento” + “oso”.
Exemplos:
Fe(OH)2: Hidróxido ferroso;
Fe(OH)3: Hidróxido férrico.
Outra maneira de nomear esses tipos de bases é pela numeração em algarismos romanos, correspondente ao seu nox:
“Hidróxido de elemento” + “numeração do nox em algarismo romano”.
Exemplos:
Fe(OH)2 → Hidróxido de ferro II;
Fe(OH)3 → Hidróxido de ferro III.

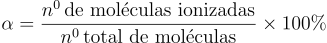

Deixe um comentário